Fica o registo das reações a um comentário feito no contexto do caso da Matilde Sande a uma Publicação do escritor Pedro Chagas para memoria futura, porque ganharam um lugar especial e são de grande apreço.
Foram 608 reações, foram mais de 70 comentários que fizeram a diferença tornando aquele evento, algo especial
Quero aqui, publicamente apresentar ao Pedro Chagas, um agradecimento especial, mas também a cada um dos que tiveram a bondade de me dirigir palavras de conforto, alento, reconhecimento e tantas outras e que foram, todas elas, recebidas com elevada estima revestindo-se para mim, de um enorme valor e significado.
A Matilde
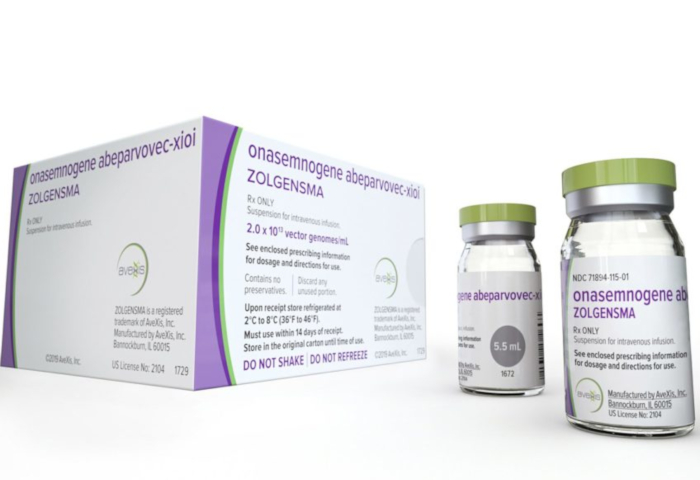
A Matilde. A Matilde passa por aquilo por que ninguém, muito menos um bebé, deveria passar. A Matilde sofre com aquilo que não deveria existir. A Matilde precisa de um tratamento de quase dois milhões de euros e eu, como contribuinte, pago para a Matilde, custe o que custar, ter esse tratamento. Já. Imediatamente. Mas não é para isso que o meu dinheiro serve.
O Estado salva instituições bancárias, salva — e ajuda a construir — fortunas inacabáveis, salva impérios eternos. Mas não consegue salvar a Matilde. Porque não há dinheiro, dizem. Que pulhice. Os milhões aparecem de todo o lado quando um gestor de um banco tosse. Mas para a Matilde não há dinheiro.
Como pai, como pessoa, tenho nojo deste Estado, do estado a que chegámos. Como pai, como pessoa, não consigo imaginar o sofrimento monstruoso pelo que passam estes pais, e quero dar-lhes, por aqui e pessoalmente se um dia puder, o abraço mais apertado que algum dia dei. Como pai, como pessoa, apetece-me chamar de tudo a quem permite que algo assim aconteça. Ladrões, salafrários, cabrões. Mas também não serão essas palavras a salvar a Matilde. O que pode salvar a Matilde é isto:
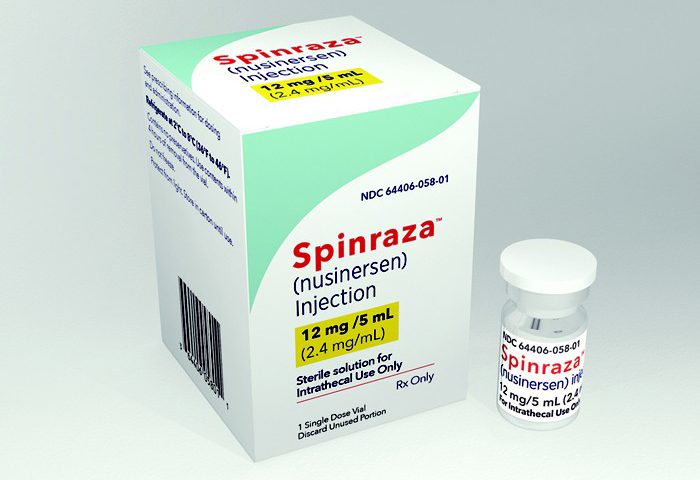
PT50 0035 0685 00008068 130 56 – Caixa Geral de Depósitos (em nome de Matilde Sande)
É esse o número da conta para a qual vou transferir, já de seguida, o que posso transferir. Façam o mesmo. E abram os olhos, e façam barulho. Façam-se ouvir. É assim, sempre, por mais que demore, por mais que pareça que não, por mais que o sistema nos queira convencer de que não, que se faz a diferença. Sejamos gente.
Tu e 10 mil outras pessoas reagiram ao post Mil comentários 27 mil partilhas
-
Francisco Rocha Lamentavelmente em Portugal esta doença já vitimou demasiados anjinhos, já no ano 2000 senti na minha própria pele esta realidade.
Visite o site do meu anjinho https://teresa.rocha.com.pt/ se estiver interessado em entender melhor esta doença
Teresa Rocha † 10/04/2000 – 08/05/2001
-
Pedro Chagas Freitas – Autor Abraço muito apertado, Francisco. De coração.
-
Cristina Moreira Francisco Rocha Um abraço do tamanho do mundo ❤️❤️
Muita força
-
Carla Quaresma Lamento tanto…um abraço do fundo do coração.
-
Teresa Mota Francisco Rocha um grande abraço muita força…
-
Marco Palmeiro Francisco, um enorme abraço de coração e tudo de bom. Muita saúde.
-
Sonia Matos Francisco Rocha ??
-
Marta Ponte Francisco Rocha ❤️???
-
Tatiana Almeida Amen Francisco Rocha um beijinho grande
-
Catarina Fernandes Francisco Rocha uma palavra de conforto e um abraço apertado!
-
Tiago Moreira Muita forca Francisco Rocha, nenhum pai e mae deveriam passar por isso, a perda de um filho deve ser muito duro muita forca
-
Ana Mourata Francisco Rocha ??❤️❤️
-
Susana Encarnação Um abraço para a família!
-
Cristiana Leite Francisco Rocha Sr Francisco lamento muito
Xi❤️ apertadinho é um grande beijinho ?
-
Cristiana Leite Pedro Chagas Freitas – Autor este texto representa tão bem aquilo que sinto .. aquilo que não percebo no nosso sistema e nas coisas!!! E como mãe doi me o coração e a alma por esta criança por estes país!!!
vou ajudar com aquilo que posso, porque pouco é muito! E juntos somos mais fortes!!! Acredito mesmo nisso!!
-
Sarah Vieira da Silva Francisco Rocha tem um anjinho Teresa a esperar por nós noutro lado ! Grande pai !
-
Sónia Gomes Francisco Rocha sem palavras pela sua coragem
-
Nuno Filipe Ribeiro Francisco um forte abraço. Não tenho palavras.
-
Raquel Vairinhos Francisco Rocha lamento muito a sua perda… um forte abraço e votos de muita força! ?
-
Baptista Barbeiro Francisco Rocha tenho um filho de 08/04/2000??neste momento com 19 anos, não consigo imaginar sequer a sua dor?forte abraço
Descansa em paz Teresa?
-
Anna Rossi ? um abraço
-
Teresa Silva Barroso Francisco Rocha muita força e coragem pra si e pra sua família!!!
-
Cristina Pimenta Francisco Rocha Quem me dera saber o que dizer depois de ler a sua mensagem. Dói…. Simplesmente dói. Nenhum pai ou mãe devia passar por esta perda. Um grande abraço
-
Nana Carneiro Santiago Lorenço 05/01/2012 – 02/09/2012
-
Joana Félix Ribeiro Um abraço Francisco e um abraço Nana Carneiro ❤️
-
Joana Silva Cunha Francisco Rocha meu Deus sinto tanto
-
Nana Almeida Francisco Rocha Que doença?
-
Rute Almeida Nana Carneiro um beijinho ?
-
Rute Almeida Francisco Rocha Força ?
-
Angélica Sá Francisco Rocha
-
Ana Maria Melo Um abraço e muita força, Sr. Francisco Rocha.
-
Ana Maria Melo Um grande abraço, Nana Carneiro. Força.
-
Francisco Rocha Nana Almeida A Doença de Werdnig-Hoffmann também é conhecida por Atrofia Muscular Espinhal Proximal ou seu acrónimo AME Tipo 1 é também designada nos países anglo-saxónicos como Spinal Muscular Atrophy ou ainda pelo seu acrónimo SMA I
-
Miguel Beirão Francisco um forte forte abraço. De coraçao…
-
Vera Santos Pedro Chagas Freitas – Autor Acha correcto Bloquear pessoas quando dão a sua opinião. ?
Quando pedem mais esclarecimentos e sugerem que seja adicionada toda a informação relacionada com os passos que estão a ser dados em relação aos contactos com o…Ver Mais
-
Joana Filipa Ferreira Francisco Rocha Um abraço grande , e muita força. Não imagino o que será perder um filho. Mas calculo que seja uma dor que ninguém deveria passar por isso, pelo menos a lei da vida não deveria ser assim. Nem submeter a estes anjinhos passarem por isso ???
-
Maria Conceição Candeias Francisco Rocha Um grande abraço. Sei que dói muito. Força…. ?
-
Andreia Chora Francisco Rocha ?
-
Sara Botelho ????
-
Joana Empis Francusco Rocha. Não ha palavras… estou do coração convosco! A Teresinha é um Anjo que vos protegerá para sempre!!!
-
Emilia Guerra Rocha Francisco Rocha eu também já senti na minha pele está realidade. Tenho um anjo no céu ???. Oxalá a Matilde tenha sorte .??????
-
Emilia Guerra Rocha Oxalá ?????.
-
Emilia Guerra Rocha Maria Conceição Candeias dói demais e para o resto da vida . Eu já passei por isto. Tenho um.anjo no céu ?????????❤️?
-
Marta Dos Santos Francisco Rocha ?❣?
-
Marta Dos Santos Rui Cardoso ?❣?
-
Marta Dos Santos Emilia Guerra Rocha ❣??
-
Marta Dos Santos Nana Carneiro ❣??
-
Tânia Vieira Jorge Ferreira Meu deus Francisco, estou agoniada. Um abracinho! Sem palavras ?
-
Jacinto Pinheiro Subscrevo na íntegra o texto de Pedro Chagas .Vamos ser mais uma vez solidários com esta nossa criança inocente.Vamos ajudar a Matilde da nossa pequena ou grande ajuda está a vida desta criança.Um muito bem haja a todos.
-
Cláudia Belo Gonçalves Francisco Rocha um grande abraço! Muita força!
-
Andrea Silva O Brasil acabou de colocar o medicamento de alto custo pelo SUS.
-
Sandra Fernandes Lamento muito…um abraço apertado!
-
Andréa Joana d’Oliveira Francisco Rocha Obrigada pela sua partilha e pelo seu trabalho. Um abraço e muita força!
-
Ines Silva Vera Santos eu fui criticada num grupo por perguntar o mesmo, pq não estou em Portugal e não vejo Cristina’s e gouchas e claro há mtas fraudes. Mas existe a página da Matilde. De uma olhada foi o q eu fiz.
-
Maria Celeste Silva Francisco…um filho é um pedaço de nós.Lutamos por eles até á última instância.Mta força para vós,porque não é fácil.Deus vós proteja.
-
Cristina Fernandes Francisco Rocha lamento muito a sua perda. Uma abraço apertado de conforto. Que mundo ingrato este em que vivemos :'(
-
Andreia Jesus Francisco Rocha não sabia ? Lamento imenso… ☹️ Nenhum pai ou mãe deveria passar por um sofrimento destes! ?
-
Helena Taube Francisco Rocha ??❤
-
Luis Almeida Francisco Rocha ?
-
Vanda Santos Eu também perdi a minha primeira filha com esta doença tinha 6 mesinhos a minha Catarina, toda a sorte do mundo para a Matilde….hoje tenho uma Lara com 20 anos e um Miguel com 15….e o meu anjinho no céu para nos proteger que teria agora 21 anos
-
Maria Do Carmo Pinto Um Grande abraço Sr Francisco Rocha ❤???
-
Maria Do Carmo Pinto Pedro Chagas Freitas – Autor posso por o seu texto no meu mural agradeço, assim poderemos tornar viral talvez chegue a essa cambada de corruptos ,
-
Luisa Machado Baptista Barbeiro ,pensei exatamente o mesmo quando li o comentário deste pai. O meu filho é de 24/4/2000. Descansa em paz anjinho.???
-
Joana Cunha Francisco Rocha muita força! E penso que divulgar informação acerca da doença e tratamentos é a melhor homenagem que podem fazer à vossa princesinha…
-
Marisa Anjos Francisco Rocha os meus sinceros sentimentos ninguém merece uma doença destas quanto mais um bebé
-
Sonia Mendes Francisco Rocha Os meus sentimentos… A vida não é justa muitas vezes.. Muita força para vocês
-
Tania Baptista Lamento imenso pela sua querida filha ñ imagino semelhante dor…
Um abraço apertado…
-
Aura Correia Francisco Rocha ?
-
Silvia Pereira Francisco Rocha contra mim falo, soube da doença pelo caso da Matilde e não tinha noção de que sendo uma doença rara afectava tantas crianças em Portugal. É tempo de ajudar todas e tentar que o medicamento fique acessível em Portugal. Lamento imenso a sua perda. Já perdi 2 filhas por outros motivos mas sei que não há dor maior.
-
Francisco Rocha Silvia Pereira
A Matilde já tem o valor necessário para pagar o tratamento?
mas agora é preciso não esquecer que existem mais 9 casos como o da Matilde em Portugal!!!
“Há mais 9 ‘Matildes’ no país” ☹️
[Joaquim Brites: Presidente da APN / Associação Portuguesa de Neuromusculares]
Quem estiver interessado/a em conhecer melhor a doença da Matilde, convido a visitar a Pagina do Projeto Teresa Rocha em https://teresa.rocha.com.pt





Comentários recentes